

イーヘルスクリニック新宿院 院長の天野です。
今年最初の記事では、「本年は皆様と一緒に『Longevity(ロンジェビティ)』というテーマについて、より深く考えていきたいと思っております」と書かせていただきました。
今日はそのテーマをさらに深掘りし、現代医学における最重要トピックの一つである「老化(Aging)」について、少し専門的な領域まで踏み込んで解説していきたいと思います。
「加齢(エイジング)」は、すべての人に共通する、時間とともに進行する生物学的なプロセスです。
かつて、それは避けられない「運命」として受け入れられてきました。しかし、近年の生命科学の急速な進展は、この見方を根本から変えようとしています。
最先端の科学が明らかにしつつあるのは、加齢は「単一の理由で起こる不可避な衰え」ではなく、「複数の要因が複雑に絡み合いながら進行するプロセス」であるという事実です。
そして何より重要なのは、そのプロセスには「医学的な介入の余地がある」ことが示唆され始めている点です。
この「加齢」という最も複雑な生命現象を理解し、介入するための羅針盤となっているのが、スペインのオビエド大学、Carlos López-Otín(カルロス・ロペス=オティン)教授ら世界的権威によって提唱された「Hallmarks of Aging(加齢の特徴)」という概念です。
2013年に9つの特徴が示された画期的な論文 (López-Otín et al. 2013) は、世界中の加齢研究の方向性を決定づけました。
それから約10年、膨大な研究の蓄積を経て、2023年に彼らはこのリストを12の特徴へとアップデートしました (López-Otín et al. 2023)。
特に3番目が極めて重要です。これは、これらの特徴が「傍観するしかない結果」ではなく、「治療や予防が可能なターゲット(的)」であることを意味します。
つまり近い将来、検査でこれらを測定し、それぞれに対して的確な介入を行うことで、健康寿命を延ばす医療が実現可能になるのです。
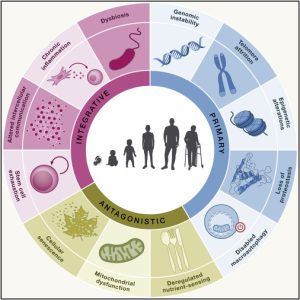
それでは、12のHallmarksを一つずつ見ていきましょう。
これらは2013年からのオリジナル9項目と、2023年に新たに追加(あるいは独立・格上げ)された3項目に大別されます。
概要:生命の「設計図」であるDNAに、傷や変異が蓄積すること。
私たちの身体では、毎日、紫外線、放射線、化学物質、あるいは細胞自身の代謝活動によって、DNAに無数の損傷(いわば「設計図の誤植やシミ」)が発生しています。
若い細胞には、これらを修復する強力な「校正・修復チーム」が備わっています。しかし加齢とともに、この修復能力が低下したり、損傷の発生ペースが上回ったりすると、修復しきれない傷や変異がゲノム(遺伝情報全体)に蓄積していきます。これが機能不全やがん化のリスクを高めます。
概要:染色体を保護する「キャップ」であるテロメアが、細胞分裂のたびに短くなること。
テロメアは、よく「靴紐の先端のプラスチック(アグレット)」に例えられます。あのアグレットが靴紐の先端をほつれから守るように、テロメアは染色体の末端を保護しています。
細胞が分裂するたびに、このテロメアは(設計上)少しずつ短くなっていきます。そして、一定の短さ(限界)に達すると、それ以上分裂すると染色体(設計図)本体が危険にさらされるため、細胞は分裂を永久に停止します(これが後述の「細胞老化」の一因となります)。
概要:DNAの設計図(塩基配列)は変わらないが、その「使い方」の制御が乱れること。
身体のすべての細胞(皮膚、神経、筋肉など)は同じDNAの設計図を持っています。違いは、その設計図の「どのページを読み、どのページを閉じておくか」という「使い方(遺伝子のオン/オフ)」にあります。
この制御システムをエピジェネティクス(DNAへの化学的な「付箋」や「ハイライト」のようなもの)と呼びます。加齢により、この「付箋」が剥がれたり、間違った場所についたりして制御パターンが混乱し、本来オフであるべき遺伝子がオンになったり、必要な遺伝子がオフになったりします。
概要:タンパク質の「品質管理システム」が破綻すること。
「プロテオスタシス」とは「タンパク質(Protein)の恒常性(Homeostasis)」を意味する造語です。細胞という工場では、日々、新しい製品(タンパク質)が作られ、正しく折り畳まれ(成形)、機能しています。
そして不要になったり不良品が出たりすると、分解・除去されます。この一連の「品質管理(QC)」と「廃棄物処理」のシステムがプロテオスタシスです。加齢によりこのシステムが機能不全に陥ると、不良品(異常タンパク質)が工場内に蓄積し、細胞機能が障害されます。アルツハイマー病などに見られるアミロイドβの蓄積も、この一例と考えられています。
概要:細胞が「栄養が十分にある」と誤解し続け、修復モードに切り替われないこと。
細胞には、周囲の栄養状態を感知するセンサー(インスリン/IGF-1経路やmTOR経路など)があります。栄養が豊富な時、細胞は「成長・増殖」モードになります。逆に、栄養が乏しい時(例えば適度な空腹時)は、「省エネ・修復」モード(後述のオートファジーなど)に切り替わります。
加齢や飽食のライフスタイルにより、このセンサーが常に「栄養過多」シグナルを出し続けると、細胞は修復を怠り、老化が促進されると考えられています。
概要:細胞の「エネルギー工場」であるミトコンドリアの質と機能が低下すること。
ミトコンドリアは、私たちが呼吸で得た酸素と食事で得た栄養素を使って、活動エネルギー(ATP)を生み出す「エネルギー工場」です。
加齢に伴い、この工場の効率が低下すると、エネルギー産生が滞るだけでなく、プロセスの中で生じる有害な副産物(活性酸素、いわば「工場の排煙」)の量が増加します。これが細胞自身を傷つけ、さらなる機能低下を招く悪循環に陥ります。
概要:分裂を停止した「老化細胞」が蓄積し、周囲に悪影響を及ぼすこと。
ゲノム不安定性やテロメア短縮などで深刻なダメージを受けた細胞は、がん化を防ぐための安全装置として、分裂を永久に停止します。これが「細胞老化」です。
問題は、この老化細胞がただ「働かない」だけでなく、「SASP(サスプ)因子」と呼ばれる様々な炎症性物質などを周囲に撒き散らし始めることです。これにより、周囲の正常な細胞まで機能不全に陥らせたり、慢性的な炎症を引き起こしたりします(いわば「サビを撒き散らす古い機械」のような状態です)。
概要:組織を修復・再生するための「予備の細胞(幹細胞)」が尽きること。
私たちの皮膚や血液、腸などの組織は、日々新しい細胞に入れ替わっています。その供給源となるのが「幹細胞」という「新しい細胞を生み出す能力」を持った特別な細胞です。
加齢により、この幹細胞自体が老化したり、数が減少したりすると、組織の修復・再生能力が追いつかなくなります。これが、傷が治りにくくなったり、臓器の機能が低下したりする一因となります。
概要:細胞同士の情報伝達が混乱し、特に「炎症シグナル」が増加すること。
私たちの身体は、約37兆個とも言われる細胞が、ホルモンや神経伝達物質、サイトカインといった情報伝達物質を使って精緻に連携し合うことで成り立っています。
加齢により、このコミュニケーションシステムが乱れ、特に炎症を引き起こすシグナル(炎症性サイトカイン)が過剰になる傾向があります。これが次に述べる「慢性炎症」の背景となります。
以下の3つは、2013年版では他の特徴の一部として議論されていましたが、この10年の研究でその重要性が極めて高まり、独立したHallmarkとして「格上げ」されたものです。
概要:細胞内の「大規模リサイクルシステム」が機能しなくなること。
オートファジー(自食作用)は、細胞内の古くなった部品(ミトコンドリアなど)や不要なタンパク質の塊を分解し、再利用可能な資源(アミノ酸など)にリサイクルする、細胞にとって不可欠な「お掃除&リサイクル」システムです。
これは「プロテオスタシス」とも密接に関連しますが、オートファジーはより大規模な構造物(細胞小器官など)を丸ごと処理できる点で区別されます。加齢によりこの機能が低下すると、細胞内に有害なゴミが溜まり、機能不全に陥ります。
概要:明確な原因がないにもかかわらず、微弱な炎症が全身でくすぶり続けること。
炎症は本来、怪我や感染から身体を守るための重要な「火事の警報・消火システム」です。しかし、加齢に伴い、老化細胞(SASP因子)の蓄積や、後述の腸内環境の悪化などにより、明確な「火元」がないのに警報が鳴り続け、常に「小さな火事」が全身でくすぶっているような状態になります。これが「慢性炎症(Inflammaging)」です。
この微弱な炎症が、動脈硬化、糖尿病、アルツハイマー病など、多くの加齢関連疾患の共通基盤であると考えられています。
概要:腸内細菌など、体内に共生する微生物のバランスが崩れること。
私たちの腸内には数百兆個もの微生物(腸内マイクロバイオーム)が共生しており、消化吸収の補助だけでなく、免疫機能の調節や、さらには脳の機能にまで影響を与えていることが分かってきました。
加齢や食生活の乱れにより、この微生物生態系のバランスが崩れ、多様性が失われたり、望ましくない菌(いわゆる悪玉菌)が増えたりする状態を「ディスバイオシス」と呼びます。これが腸のバリア機能の低下を招き、有害物質が体内に漏れ出すことで「慢性炎症」を引き起こす一因とも考えられています。
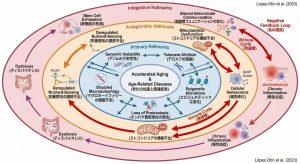
ここで最も強調したいのは、これら12の特徴がバラバラに存在するのではなく、互いに複雑に絡み合い、「負の連鎖」を形成しているという点です。
この相互作用の理解こそが、介入点を考える上で非常に重要になります。
Carlos López-Otín教授らが提示した12の「Hallmarks of Aging」は、加齢を「不可避な衰え」から「介入可能な生物学的プロセス」へと捉え直すための、現時点で最も信頼できる科学的な羅針盤です。
近い将来、これらの老化に関連する因子を医学的にコントロールできる未来が必ず訪れます。
例えば、ビタミンCやCoQ10による抗炎症作用・ミトコンドリア活性化、糖尿病薬であるSGLT2阻害薬やメトホルミンによる老化細胞除去・mTOR阻害メカニズムなど、様々な候補薬がすでに研究されています。
しかし、未来の薬を待つ必要はありません。
この複雑な老化メカニズムを、毎日の生活習慣でポジティブに修正することは今すぐにでも可能です。
細胞レベルで若さを保つ鍵のひとつが、「抗炎症・抗酸化」に寄せた食事です。
私たちの身体を作る材料である「食事」が、実際に遺伝子の寿命(テロメア)に影響を与えることが、大規模な研究によって証明されています。
地中海ダイエットをより実行している人は、そうでない人に比べ、テロメア長が長い傾向にあることが判明しました。
米国ハーバード・メディカル・スクールのMarta Crous-Bou氏らが、米国看護師健康調査(Nurses’ Health Study)の参加者について、コホート内症例対照研究を行い明らかにしました。
【研究内容】
1976年から12万1,700例を対象に実施されている米国看護師健康調査の参加者のうち、疾患の認められない4,676例について分析。対象者の末梢血白血球中の相対的テロメア長をリアルタイムPCR(RT-PCR)法で測定し、食事内容(地中海食スコア)との関連を調査しました。
【結果】
潜在的交絡因子で補正を行った後、地中海ダイエットをより順守している人は、テロメア長が有意に長いことがわかりました。
(テロメア長の最小二乗平均zスコア:地中海ダイエット・スコア最低群 -0.038 vs 最高群 0.072, p=0.004)
つまり、食事の質が細胞寿命(テロメア)を直接的に保護している可能性が示されたのです。
では、具体的にどのような選択をすればよいのでしょうか?
まずは、今日からできるシンプルな選択から始めてみてください。
🥑 今日からできるシンプルな選択
イーヘルスクリニック新宿院では、医学的根拠に基づいた「生物学的年齢の測定」、「サプリメント療法」や「栄養療法」の相談を受け付けています。
ご自身のパフォーマンスを最大化するためのパートナーとして、ぜひ当院をご活用ください。
この記事の監修者
天野 方一(イーヘルスクリニック新宿院 院長)
埼玉医科大学卒業後、都内の大学附属病院で研修を修了。東京慈恵会医科大学附属病院、足利赤十字病院、神奈川県立汐見台病院などに勤務、研鑽を積む。2016年より帝京大学大学院公衆衛生学研究科に入学し、2018年9月よりハーバード大学公衆衛生大学院(Harvard T.H. Chan School of Public Health)に留学。予防医療に特化したメディカルクリニックで勤務後、2022年4月東京都新宿区に「イーヘルスクリニック新宿院」を開院。複数企業の嘱託産業医としても勤務中。
日本腎臓学会専門医・指導医、抗加齢医学会専門医、日本医師会認定産業医、公衆衛生学修士、博士(公衆衛生学)

この記事の運営者:イーヘルスクリニック新宿院